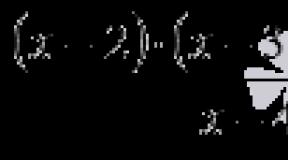Все задания по химии. Составление и решение химических уравнений. Определение выхода продукта реакции в % от теоретически возможного
Задача 1-1. Сколько молекул содержится в одном литре воды?
Решение
.
Масса одного литра воды:
г.
Количество вещества - удобная универсальная величина, через которую можно связать между собой число атомов или молекул, массу и объем вещества.
Количество вещества можно рассчитать по следующим формулам:![]()
где
- масса,
- молярная масса,
- число атомов или молекул,![]() моль -1 - постоянная Авогадро.
моль -1 - постоянная Авогадро.
Молярная масса воды:![]() (г/моль).
(г/моль).
Пользуясь этими формулами, находим: (моль);
(моль);
Ответ:
Задача 1-2. Сколько атомов водорода содержится: а) в 10 моль аммиака; б) в 100 г воды?
Решение.
а) Формула аммиака - . Эта формула означает, что в одной молекуле аммиака содержится три атома водорода, а в любом количестве аммиака атомов водорода в три раза больше, чем молекул. Следовательно,
моль;
б) В одной молекуле воды содержится два атома водорода, поэтому в любом количестве воды атомов водорода в два раза больше, чем молекул: ![]() . количество вещества воды можно определить по массе:
. количество вещества воды можно определить по массе: (моль);
(моль);
(моль);
.
Ответ:
а) ; б) .
Задача 1-3. Вычислите массу кислорода, содержащуюся в 15,0 г серной кислоты.
Решение.
Молярная масса серной кислоты (г/моль).
Количество вещества (моль).
(моль).
Согласно химической формуле в 1 моль серной кислоты содержится 4 моль кислорода, поэтому![]() моль.
моль.
Зная количество кислорода, можно найти его массу:
г.
Ответ:
9,79 г кислорода.
Задача 1-4. Рассчитайте массу одной молекулы гемоглобина (молекулярная формула ): а) в граммах; б) в атомных единицах массы.
Решение.
а) Для расчета массы молекулы гемоглобина надо знать молярную массу гемоглобина:
г/моль.
Дальше можно использовать два способа.
Объединяя формулы ![]() ,
,
можно выразить массу через число молекул: .
.
Подставляя в эту формулу , г/моль, ![]() моль -1 ,
моль -1 ,
находим г.
б) Абсолютная масса молекулы равна относительной молекулярной массе, умноженной на 1 а. е. м. Относительная молекулярная масса численно равна молярной массе, поэтому масса одной молекулы гемоглобина равна 64388 а. е. м.
Ответ:
а) ![]() ; б) 64388 а. е. м.
; б) 64388 а. е. м.
Задача 1-5. Рассчитайте массовые доли водорода и кислорода в воде.
Решение.
В этой задаче водород и кислород - это элементы и , а не простые вещества и . Массовая доля определяется как отношение массы элемента к массе вещества:
Удобное свойство массовой доли состоит в том, что она не зависит от общей массы вещества: массовые доли элементов одинаковы и в капле, и в литре, и в бочке воды. Поэтому для расчета массовой доли можно взять любую массу вещества, например 1 моль.
Масса 1 моль воды: г. Согласно формуле воды в 1 моль воды содержится 2 моль атомов водорода и 1 моль атомов кислорода:
(г);
(г).
Массовые доли элементов:![]() %;
%;![]() %.
%.
Ответ:
11,1% H, 88,9% O.
Задача 1-6. Определите простейшую формулу химического соединения, если массовые доли составляющих его элементов равны: H - 2,04%, S - 32,65%, O - 65,31%.
Решение.
Простейшая формула отражает соотношение между числом атомов в молекуле, или, что то же, мольные соотношения атомов. Поскольку простейшая формула не зависит от массы вещества, возьмем образец вещества массой 100 г и найдем отношение количеств элементов (в молях) в этом образце. Для этого следует разделить массу каждого элемента на его- относительную атомную массу:
Наименьшее из чисел (1,02) принимаем за единицу и находим отношение:
Оно означает, что в молекуле химического соединения на 2 атома водорода приходится 1 атом серы и 4 атома кислорода, следовательно, простейшая формула искомого соединения - .
Ответ:
.
Задача 1-7. Определите молекулярную формулу органического вещества, если оно содержит 40% углерода, 6,7% водорода и 53,3% кислорода по массе, а его молярная масса равна 60 г/моль.
Решение.
Действуя так же, как и в предыдущей задаче, можно найти относительные количества элементов и определить простейшую формулу вещества:
Простейшая формула вещества - . Ей соответствует молярная масса ![]() (г/моль). Молярная масса вещества равна 60 г/моль, следовательно, истинная формула равна простейшей формуле, умноженной на 2, т. е. .
(г/моль). Молярная масса вещества равна 60 г/моль, следовательно, истинная формула равна простейшей формуле, умноженной на 2, т. е. .
Ответ:
.
Задача 1-8. Какая масса хлорида натрия образуется при обработке 15 г карбоната натрия, содержащего 15% примесей, избытком соляной кислоты?
Решение.
Прежде всего найдем массу чистого карбоната натрия. Примесей в образце карбоната натрия содержится 15%, а чистого вещества - 85% :
(г).
Далее запишем уравнение химической реакции:
Na 2 CO 3 + 2HCl = 2NaCl + CO 2 + H 2 O
.
Массу продуктов реакции можно рассчитать по количеству вещества, используя следующую схему:
m(исх. вещества) → v(исх. вещества) → v(продукта) → m(продукта)
.
Найдем количество карбоната натрия: (моль).
(моль).
По основному закону химической стехиометрии отношение количеств реагирующих веществ (в молях) равно отношению соответствующих коэффициентов в уравнении реакции. Коэффициент перед в 2 раза больше, чем коэффициент перед , поэтому количество хлорида натрия также в 2 раза больше: моль.
Масса хлорида натрия:
(г).
Ответ:
14 г .
МуниципальноЕ БЮДЖЕТНОЕ общеобразовательнОЕ учреждениЕ
«Средняя общеобразовательная школа № 37
с углублённым изучением отдельных предметов»
г. Выборг, Ленинградская область
«Решение расчётных задач повышенного уровня сложности»
(материалы по подготовке К ЕГЭ)
учитель химии
Подкладова Любовь Михайловна
2015 г.
Статистика проведения ЕГЭ свидетельствует, что примерно половина школьников справляется с половиной заданий. Анализируя итоги проверки результатов ЕГЭ по химии обучающихся нашей школы, я пришла к выводу, что необходимо усилить работу по решению расчётных задач, поэтому выбрала методическую тему «Решение задач повышенной сложности».
Задачи - особый вид заданий, требующий от обучающихся применения знаний в составлении уравнений реакций, иногда нескольких, составления логической цепочки в проведении расчётов. В результате решения из определенного набора исходных данных должны быть получены новые факты, сведения, значения величин. Если алгоритм выполнения задания заранее известен, оно превращается из задачи в упражнение, цель которых – превращение умений в навыки, доведение их до автоматизма. Поэтому на первых занятиях по подготовке обучающихся к ЕГЭ напоминаю о величинах и единицах их измерения.
Величина
Обозначение
Единицы измерения
в разных системах
г, мг, кг, т, …*(1г = 10 -3 кг)
л, мл, см 3 , м 3 , …
*(1мл = 1см 3 , 1 м 3 = 1000л)
Плотность
г/ мл, кг/ л, г/ л,…
Относительная атомная масса
Относительная молекулярная масса
Молярная масса
г/ моль, …
Молярный объём
V m или V M
л/моль, …(при н.у. – 22,4 л/моль)
Количество вещества
моль, кмоль, млмоль
Относительная плотность одного газа по другому
Массовая доля вещества в смеси или растворе
Объёмная доля вещества в смеси или растворе
Молярная концентрация
моль/ л
Выход продукта от теоретически возможного
Постоянная Авогадро
N A
6,02 10 23 моль -1
Температура
t 0 или
по шкале Цельсия
по шкале Кельвина
Давление
Па, кПа, атм., мм. рт. ст.
Универсальная газовая постоянная
8,31 Дж/моль∙ К
Нормальные условия
t 0 = 0 0 C или Т = 273К
Р = 101,3 кПа = 1атм = 760 мм. рт. ст.
Затем предлагаю алгоритм решения задач, который использую на протяжении нескольких лет в своей работе.
«Алгоритм решения расчётных задач».
V (р-ра) V (р-ра)
↓ρ ∙ V m / ρ
m (р-ра) m (р-ра)
↓m ∙ ω m / ω
m (в-ва) m (в-ва)
↓ m / M M ∙ n
n 1 (в-ва) -- по ур. р-ции. → n 2 (в-ва) →
V (газа) / V M ↓ n ∙ V M
V 1 (газа) V 2 (газа )
Формулы, используемые для решения задач.
n = m / M n (газа) = V (газа) / V M n = N / N A
ρ = m / V
D = M 1(газа) / M 2(газа)
D (H 2 ) = M (газа) / 2 D (возд.) = M ( газа) / 29
(М (Н 2 ) = 2 г/моль; М (возд.) = 29 г/моль)
ω = m (в-ва) / m (смеси или р-ра) = V (в-ва) / V (смеси или р-ра)
= m (практ.) / m (теор.) = n (практ.) / n (теор.) = V (практ.) / V (теор.)
С = n / V
М (смеси газов) = V 1 (газа) ∙ M 1(газа) + V 2 (газа) ∙ M 2(газа) / V (смеси газов)
Уравнение Менделеева – Клапейрона:
P ∙ V = n ∙ R ∙ T
Для сдачи ЕГЭ, где типы заданий достаточно стандартны (№24, 25, 26), обучающемуся нужно прежде всего показать знание стандартных алгоритмов вычислений, и только в задании №39 ему может встретиться задание с неопределенным для него алгоритмом.
Классификация химических задач повышенной сложности затруднена тем, что большинство из них – задачи комбинированные. Я разделила расчетные задачи на две группы.
1.Задачи без использования уравнений реакций. Описывается некоторое состояние вещества или сложной системы. Зная одни характеристики этого состояния, надо найти другие. Примером могут служить задачи:
1.1 Расчеты по формуле вещества, характеристикам порции вещества
1.2 Расчеты по характеристикам состава смеси, раствора.
Задачи встречаются в ЕГЭ - № 24. Для обучающихся решение таких задач не вызывает затруднений.
2. Задачи с использованием одного или нескольких уравнений реакций. Для их решения кроме характеристик веществ надо использовать и характеристики процессов. В задачах этой группы можно выделить следующие типы задач повышенной сложности:
2.1 Образование растворов.
1) Какую массу оксида натрия необходимо растворить в 33,8 мл воды, чтобы получить 4%-ный раствор гидроксида натрия.
Найти:
m (Na 2 O )
Дано:
V (H 2 O ) = 33.8 мл
ω (NaOH ) = 4%
ρ (H 2 O ) = 1 г/мл
М (NaOH ) = 40 г/моль
m (H 2 O) = 33.8 г
Na 2 O + H 2 O = 2 NaOH
1 моль 2моль
Пусть масса Na 2 O = x .
n (Na 2 O) = x/62
n (NaOH) = x/31
m (NaOH ) = 40x /31
m (р-ра) = 33.8 + x
0,04 = 40x /31∙ (33.8 + x )
x = 1,08, m (Na 2 O ) = 1,08 г
Ответ: m (Na 2 O ) = 1,08 г
2) К 200 мл раствора гидроксида натрия (ρ = 1,2 г/мл) с массовой долей щёлочи 20% добавили металлический натрий массой 69 г.
Какова массовая доля вещества в образовавшемся растворе?
Найти:
ω 2 (NaOH )
Дано:
V (NaO Н) р-ра = 200 мл
ρ (р-ра) = 1,2 г/мл
ω 1 (NaOH ) = 20%
m (Na ) = 69 г
М (Na ) =23 г/моль
Металлический натрий взаимодействует с водой в растворе щёлочи.
2Na + 2H 2 O = 2 NaOH + H 2
1 моль 2моль
m 1 (р-ра) = 200 ∙ 1,2 = 240 (г)
m 1 (NaOH ) в-ва = 240 ∙ 0,2 = 48 (г)
n (Na ) = 69/23 = 3 (моль)
n 2 (NaOH ) = 3 (моль)
m 2 (NaOH ) = 3 ∙ 40 = 120 (г)
m общ. (NaOH ) =120 + 48 = 168 (г)
n (Н 2) = 1,5 моль
m (H 2) = 3 г
m (р-ра после р-ции) = 240 + 69 – 3 = 306 (г)
ω 2 (NaOH ) = 168 / 306 = 0,55 (55%)
Ответ: ω 2 (NaOH ) = 55%
3) Какую массу оксида селена(VI ) следует добавить к 100 г 15%-ного раствора селеновой кислоты, чтобы увеличить её массовую долю вдвое?
Найти:
m (SeO 3)
Дано:
m 1 (H 2 SeO 4) р-ра = 100 г
ω 1 (H 2 SeO 4) = 15%
ω 2 (H 2 SeO 4) = 30%
М (SeO 3) =127 г/моль
М (H 2 SeO 4) =145 г/моль
m 1 (H 2 SeO 4 ) = 15 г
SeO 3 + H 2 O = H 2 SeO 4
1 моль 1моль
Пусть m (SeO 3) = x
n (SeO 3 ) = x/127 = 0.0079x
n 2 (H 2 SeO 4 ) = 0.0079x
m 2 (H 2 SeO 4 ) = 145 ∙ 0.079x = 1.1455x
m общ . (H 2 SeO 4 ) = 1.1455x + 15
m 2 (р-ра) = 100 + х
ω (NaOH ) = m (NaOH ) / m (р-ра)
0,3 = (1.1455x + 1) /100 + x
x = 17,8, m (SeO 3 ) = 17,8 г
Ответ: m (SeO 3) = 17,8 г
2.2 Расчет по уравнениям реакций, когда одно из веществ находится в избытке/
1) К раствору, содержащему 9,84 г нитрата кальция, прибавили раствор, содержащий 9,84 г ортофосфата натрия. Образовавшийся осадок отфильтровали, а фильтрат выпарили. Определите массы продуктов реакции и состав сухого остатка в массовых долях после выпаривания фильтрата, если считать, что образуются безводные соли.
Найти:
ω (NaNO 3)
ω (Na 3 PO 4)
Дано:
m (Сa (NO 3) 2)= 9,84 г
m (Na 3 PO 4)= 9,84 г
М (Na 3 PO 4) = 164 г/моль
М (Сa (NO 3) 2)=164 г/моль
М (NaNO 3) =85 г/моль
М (Ca 3 (PO 4) 2) = 310 г/моль
2Na 3 PO 4 + 3 Сa(NO 3 ) 2 = 6NaNO 3 + Ca 3 (PO 4 ) 2 ↓
2 моль 3 моль 6 моль 1 моль
n (Сa(NO 3 ) 2 ) общ . = n (Na 3 PO 4 ) общ . = 9,84/164 =
Сa (NO 3) 2 0,06/3 < 0,06/2 Na 3 PO 4
Na 3 PO 4 взято в избытке,
расчёты проводим по n (Сa (NO 3) 2).
n (Ca 3 (PO 4) 2) = 0,02 моль
m (Ca 3 (PO 4) 2) = 310 ∙ 0,02 = 6,2 (г)
n (NaNO 3) = 0,12 моль
m (NaNO 3) = 85 ∙ 0,12 = 10,2 (г)
В состав фильтрата входит раствор NaNO 3 и
раствор избытка Na 3 PO 4.
n прореаг. (Na 3 PO 4) =0,04 моль
n ост. (Na 3 PO 4) = 0,06 - 0,04 = 0,02(моль)
m ост. (Na 3 PO 4) = 164 ∙ 0,02 = 3,28 (г)
Сухой остаток содержит смесь солей NaNO 3 и Na 3 PO 4.
m (сух.ост.) = 3,28 + 10,2 = 13,48 (г)
ω (NaNO 3) = 10,2 / 13,48 = 0,76 (76%)
ω (Na 3 PO 4) = 24%
Ответ: ω (NaNO 3) = 76%, ω (Na 3 PO 4) = 24%
2) Сколько литров хлора выделится, если к 200 мл 35% - ной соляной кислоты
(ρ =1,17 г/мл) добавить при нагревании 26,1 г оксида марганца (IV ) ? Сколько г гидроксида натрия в холодном растворе прореагирует с этим количеством хлора?
Найти:
V (Cl 2)
m (NaO Н)
Дано:
m (MnO 2) = 26,1 г
ρ (HCl р-ра) = 1,17 г/мл
ω (HCl ) = 35%
V (HCl ) р-ра) = 200 мл.
М (MnO 2) =87 г/моль
М (HCl ) =36,5 г/моль
М (NaOH ) = 40 г/моль
V (Cl 2) = 6,72 (л)
m (NaOH ) = 24 (г)
MnO 2 + 4 HCl = MnCl 2 +Cl 2 + 2 H 2 O
1 моль 4моль 1 моль
2 NaO Н + Cl 2 = Na Cl+ Na ClO + H 2 O
2 моль 1 моль
n (MnO 2) =26.1 /87 = 0,3(моль)
m р-ра (НCl ) = 200 ∙ 1,17 = 234 (г)
m общ. (НCl ) = 234 ∙ 0,35 = 81,9 (г)
n (НCl ) = 81,9 /36,5 = 2,24(моль)
0,3 < 2.24 /4
НCl - в избытке, расчёты по n (MnO 2)
n (MnO 2) = n (Cl 2) =0,3 моль
V (Cl 2) = 0,3∙ 22,4 = 6,72 (л)
n (NaOH ) = 0,6 моль
m (NaOH ) = 0,6 ∙ 40 = 24 (г)
2.3 Состав раствора, полученного в ходе реакции.
1) В 25 мл 25%-ного раствора гидроксида натрия (ρ =1,28 г/мл) растворён оксид фосфора (V ), полученный при окислении 6,2 г фосфора. Какого состава образуется соль и какова её массовая доля в растворе?
Найти:
ω (соли)
Дано:
V (NaOH ) р-ра = 25 мл
ω (NaOH ) = 25%
m (Р) = 6,2 г
ρ (NaOH ) р-ра = 1,28 г/мл
М (NaOH ) = 40 г/моль
М (Р) =31 г/моль
М (Р 2 О 5) = 142 г/моль
М (NaH 2 РО 4) = 120г/моль
4Р + 5О 2 = 2 Р 2 О 5
4моль 2моль
6 NaO Н + Р 2 О 5 = 2 Na 3 РО 4 + 3 H 2 O
4 NaO Н + Р 2 О 5 = 2 Na 2 H РО 4 + H 2 O
n (Р) =6,2/31 = 0,2 (моль)
n (Р 2 О 5) = 0,1 моль
m (Р 2 О 5) = 0,1 ∙ 142 = 14,2 (г)
m (NaO Н) р-ра = 25 ∙ 1,28 = 32 (г)
m (NaO Н) в-ва =0,25 ∙ 32 = 8 (г)
n (NaO Н) в-ва = 8/40 = 0,2 (моль)
По количественному соотношению NaO Н и Р 2 О 5
можно сделать вывод, что образуется кислая соль NaH 2 РО 4.
2 NaO Н + Р 2 О 5 + H 2 O = 2 NaH 2 РО 4
2моль 1 моль 2моль
0,2моль 0,1 моль 0,2моль
n (NaH 2 РО 4) = 0,2 моль
m (NaH 2 РО 4) = 0,2 ∙ 120 = 24 (г)
m (р-ра после р-ции) = 32 + 14,2 = 46,2 (г)
ω (NaH 2 РО 4) = 24/ 46,2 = 0 52 (52%)
Ответ: ω (NaH 2 РО 4) = 52%
2) При электролизе 2 л водного раствора сульфата натрия с массовой долей соли 4%
(ρ = 1,025 г/мл) на нерастворимом аноде выделилось 448 л газа (н.у.) Определите массовую долю сульфата натрия в растворе после электролиза.
Найти:
m (Na 2 O )
Дано :
V (р-ра Na 2 SO 4) = 2л = 2000 мл
ω (Na 2 SO 4 ) = 4%
ρ (р- ра Na 2 SO 4 )=1 г/ мл
М (Н 2 O ) =18 г/моль
V (О 2) = 448 л
V М = 22,4 л/ моль
При электролизе сульфата натрия проходит разложение воды, на аноде выделяется газ кислород.
2 H 2 O = 2 H 2 + О 2
2 моль 1моль
n (О 2) = 448/22,4 = 20 (моль)
n (H 2 O ) = 40 моль
m (H 2 O ) разл. = 40 ∙ 18 = 720 (г)
m (р-ра до эл-за) = 2000 ∙ 1,025 = 2050 (г)
m (Na 2 SO 4) в-ва = 2050 ∙ 0,04 = 82 (г)
m (р-ра после эл-за) = 2050 – 720 = 1330 (г)
ω (Na 2 SO 4 ) = 82 / 1330 = 0,062 (6,2%)
Ответ: ω (Na 2 SO 4 ) = 0,062 (6,2%)
2.4 В реакцию вступает смесь известного состава, необходимо найти порции затраченных реагентов, и /или полученных продуктов.
1) Определить объём смеси газов оксида серы (IV ) и азота, в которой содержится 20 % сернистого газа по массе, который надо пропустить через 1000 г 4%-ного раствора гидроксида натрия, чтобы массовые доли солей, образующихся в растворе, стали одинаковыми.
Найти:
V (газов)
Дано:
m (NaOH ) = 1000 г
ω (NaOH ) = 4%
m (средней соли) =
m (кислой соли)
М (NaOH ) =40 г/моль
Ответ: V (газов) = 156,8
NaO Н + SO 2 = NaHSO 3 (1)
1 моль 1 моль
2NaO Н + SO 2 = Na 2 SO 3 + H 2 O (2)
2 моль 1моль
m (NaOH ) в-ва = 1000 ∙ 0,04 = 40 (г)
n (NaOH ) = 40/40 = 1 (моль)
Пусть n 1 (NaOH ) = x , тогда n 2 (NaOH ) = 1 - x
n 1 (SO 2 ) = n (NaHSO 3 ) = x
M (NaHSO 3 ) = 104 x n 2 (SO 2 ) = (1 – x) / 2 = 0,5 ∙ (1 – x)
m (Na 2 SO 3) = 0,5 ∙ (1 – x ) ∙ 126 = 63 (1 – х)
104 x = 63 (1 – х)
х = 0,38 моль
n 1 (SO 2) =0,38 моль
n 2 (SO 2 ) = 0,31 моль
n общ . (SO 2 ) = 0,69 моль
m общ. (SO 2) = 0,69 ∙ 64 = 44,16 (г) – это составляет 20% от массы смеси газов. Масса газа азота составляет 80 %.
m (N 2) = 176,6 г, n 1 (N 2) = 176,6 / 28 = 6,31 моль
n общ. (газов)= 0,69 + 6,31 = 7 моль
V (газов) = 7 ∙ 22,4 = 156,8 (л)
2) При растворении 2,22 г смеси железных и алюминиевых опилок в 18,25%-ном растворе соляной кислоты (ρ = 1,09 г/мл) выделилось 1344 мл водорода (н.у.). Найдите процентное содержание каждого из металлов в смеси и определите объём соляной кислоты, который потребовался для растворения 2,22 г смеси.
Найти:
ω (Fe )
ω (Al )
V (HCl ) р-ра
Дано:
m (смеси) = 2,22 г
ρ (HCl р-ра) = 1,09 г/мл
ω (HCl ) = 18,25%
M (Fe ) = 56 г/моль
М (Al ) =27 г/моль
М (HCl ) =36,5 г/моль
Ответ: ω (Fe ) = 75.7%,
ω (Al ) = 24,3%,
V (HCl ) р-ра) = 22 мл.
Fe + 2HCl = 2 FeCl 2 + H 2
1 моль 2моль 1 моль
2Al + 6HCl = 2 AlCl 3 + 3H 2
2 моль 6 моль 3моль
n (Н 2) =1,344 /22.4 = 0.06 (моль)
Пусть m (Al ) = x , тогда m (Fe ) = 2,22 - х;
n 1 (Н 2) = n (Fe ) =(2.22 – x ) / 56
n (Al ) = х / 27
n 2 (Н 2) = 3х / 27∙ 2 = х / 18
x /18 +(2,22 – х) / 56 = 0,06
х = 0,54, m (Al ) = 0,54 г
ω (Al ) = 0,54 / 2.22 = 0.243 (24.3%)
ω (Fe ) = 75.7%
n (Al ) = 0.54 / 27 = 0.02 (моль)
m (Fe ) = 2,22 – 0.54 = 1.68 (г)
n (Fe ) =1.68 / 56 = 0,03 (моль)
n 1 (НCl ) = 0.06 моль
n (NaOH ) = 0,05 моль
m р-ра (NaOH ) = 0,05 ∙ 40/0.4 = 5 (г)
V (HCl ) р-ра = 24/1,09 = 22 (мл)
3) Газ, полученный при растворении 9,6 г меди в концентрированной серной кислоте, пропустили через 200 мл раствора гидроксида калия (ρ =1 г/мл, ω (К OH ) = 2,8 %). Какого состава образуется соль? Определить её массу.
Найти:
m (соли)
Дано:
m (Cu ) = 9.6 г
V (КO Н) р-ра = 200 мл
ω (КOH ) = 2,8%
ρ (H 2 O ) = 1 г/мл
М (Cu ) =64 г/моль
М (КOH ) =56 г/моль
М (КНSO 3) =120 г/моль
Ответ: m (КНSO 3) = 12 г
Cu + 2H 2 SO 4 = CuSO 4 + SO 2 + 2H 2 O
1 моль 1 моль
КO Н + SO 2 = KHSO 3
1 моль 1 моль
2 КO Н + SO 2 = K 2 SO 3 + H 2 O
2 моль 1моль
n (SO 2) = n (Cu ) =6,4/64 = 0,1 (моль)
m (КO Н) р-ра = 200 г
m (КO Н) в-ва = 200 г ∙ 0,028 = 5,6 г
n (КO Н) =5,6/56 = 0,1 (моль)
По количественному соотношению SO 2 и КОН можно сделать вывод, что образуется кислая соль KHSO 3.
КO Н + SO 2 = KHSO 3
1 моль 1 моль
n (КНSO 3) = 0,1 моль
m (КНSO 3) = 0,1 ∙ 120 = 12 г
4) Через 100 мл 12,33% - ного раствора хлорида железа (II ) (ρ =1.03г/мл) пропускали хлор до тех пор, пока концентрация хлорида железа (III ) в растворе не стала равна концентрации хлорида железа (II ). Определите объём поглощённого хлора (н.у.)
Найти:
V (Cl 2)
Дано:
V (FeCl 2) = 100 мл
ω (FeCl 2) = 12,33%
ρ (р-ра FeCl 2) =1,03г/мл
М (FeCl 2) = 127 г/моль
М (FeCl 3) = 162,5 г/моль
V М = 22,4 л/ моль
m (FeCl 2) р-ра = 1,03 ∙ 100 = 103 (г)
m (FeCl 2) р-в-ва = 103 ∙ 0,1233 = 12,7 (г)
2FeCl 2 + Cl 2 = 2 FeCl 3
2 моль 1моль 2моль
Пусть n (FeCl 2) прореаг. = х, тогда n (FeCl 3) обр. = х;
m (FeCl 2) прореаг. = 127х
m (FeCl 2) ост. = 12,7 - 127х
m (FeCl 3) обр. = 162,5х
По условию задачи m (FeCl 2) ост. = m (FeCl 3)
12,7 - 127х = 162,5х
х = 0,044, n (FeCl 2) прореаг. = 0,044 моль
n (Cl 2) = 0,022 моль
V (Cl 2) = 0,022 ∙ 22,4 = 0,5 (л)
Ответ: V (Cl 2) = 0,5 (л)
5) После прокаливания смеси карбонатов магния и кальция масса выделившегося газа оказалась равна массе твёрдого остатка. Определит массовые доли веществ в исходной смеси. Какой объём углекислого газа (н.у.) может быть поглощён 40 г этой смеси, находящейся в виде суспензии.
Найти:
ω (MgCO 3)
ω (CaCO 3)
Дано:
m (тв.прод.) = m (газа )
m (смеси карбонатов )=40г
М (MgO ) = 40 г/моль
М СаO = 56 г/моль
М (CO 2) = 44 г/моль
М (MgCO 3) = 84 г/моль
М (СаCO 3) = 100 г/моль
1) Проведём расчеты, используя 1 моль смеси карбонатов.
MgCO 3 = MgO + CO 2
1моль 1 моль 1моль
CaCO 3 = CaO + CO 2
1 моль 1моль 1моль
Пусть n (MgCO 3) = x , тогда n (CaCO 3) = 1 – x .
n (MgO) = x, n (CaO) = 1 - x
m (MgO) = 40x
m (СаO ) = 56 ∙ (1 – x ) = 56 – 56x
Из смеси, взятой количеством 1 моль, образуется углекислый газ, количеством 1 моль.
m (CO 2) = 44.г
m (тв.прод.) = 40x + 56 - 56x = 56 - 16x
56 - 16x = 44
x = 0,75,
n (MgCO 3) = 0,75 моль
n (СаCO 3) = 0,25 моль
m (MgCO 3) = 63 г
m (СаCO 3) = 25 г
m (смеси карбонатов) = 88 г
ω (MgCO 3) = 63/88 = 0,716 (71,6%)
ω (CaCO 3) = 28,4%
2) Суспензия смеси карбонатов при пропускании углекислого газа превращается в смесь гидрокарбонатов.
MgCO 3 + CO 2 + H 2 O = Mg(НCO 3 ) 2 (1)
1 моль 1 моль
CaCO 3 + CO 2 + H 2 O = Ca(НCO 3 ) 2 (2)
1 моль 1моль
m (MgCO 3) = 40 ∙ 0,75 = 28,64(г)
n 1 (СO 2) = n (MgCO 3) = 28,64/84 = 0,341 (моль)
m (СаCO 3) = 11,36 г
n 2 (СO 2) = n (СаCO 3) =11,36/100 = 0,1136 моль
n общ. (СO 2) = 0,4546 моль
V (CO 2) = n общ. (СO 2) ∙ V М = 0,4546∙ 22,4 = 10,18 (л)
Ответ: ω (MgCO 3) = 71,6%, ω (CaCO 3) = 28,4%,
V (CO 2 ) = 10,18 л.
6) Смесь порошков алюминия и меди массой 2,46 г нагрели в токе кислорода. Полученное твёрдое вещество растворили в 15 мл раствора серной кислоты (массовая доля кислоты 39,2%, плотность 1,33 г/мл). Смесь полностью растворилась без выделения газа. Для нейтрализации избытка кислоты потребовался 21 мл раствора гидрокарбоната натрия с концентрацией 1,9 моль/л. Вычислите массовые доли металлов в смеси и объём кислорода (н.у.), вступившего в реакцию .
Найти:
ω (Al ); ω (Cu )
V (O 2)
Дано:
m (смеси) = 2.46 г
V (NaHCO 3 ) = 21 мл=
0,021 л
V (H 2 SO 4 ) = 15 мл
ω(H 2 SO 4 ) = 39,2%
ρ (H 2 SO 4 ) = 1,33 г/ мл
С(NaHCO 3) = 1,9моль/л
М(Al )=27 г/моль
М(Cu )=64 г/моль
М(H 2 SO 4)=98 г/моль
V м = 22,4 л/моль
Ответ: ω (Al ) = 21.95%;
ω (Cu ) = 78.05%;
V (O 2) = 0,672
4Al + 3O 2 = 2Al 2 O 3
4моль 3 моль 2моль
2Cu + O 2 = 2CuO
2моль 1 моль 2 моль
Al 2 O 3 + 3H 2 SO 4 = Al 2 (SO 4 ) 3 + 3H 2 O (1)
1 моль 3 моль
CuO + H 2 SO 4 = CuSO 4 + H 2 O (2)
1 моль 1 моль
2 NaHCO 3 + H 2 SO 4 = Na 2 SO 4 + 2 H 2 O + СО 2 (3)
2 моль 1 моль
m (H 2 SO 4) р-ра =15 ∙ 1,33 = 19.95 (г)
m (H 2 SO 4) в-ва = 19.95 ∙ 0,393 = 7,8204 (г)
n (H 2 SO 4) общ = 7,8204/98 = 0,0798 (моль)
n (NaHCO 3) = 1,9 ∙ 0,021 = 0,0399 (моль)
n 3 (H 2 SO 4 ) = 0,01995 (моль)
n 1+2 (H 2 SO 4 ) =0,0798 – 0,01995 = 0,05985 (моль)
4) Пусть n (Al) = x, . m (Al) = 27x
n (Cu) = y, m (Cu) = 64y
27x + 64y = 2,46
n (Al 2 O 3 ) = 1,5x
n (CuO) = y
1,5x + y = 0.0585
x = 0,02; n (Al) = 0.02 моль
27x + 64y = 2,46
y = 0,03; n (Cu) = 0,03 моль
m (Al) = 0,02 ∙ 27 = 0,54
ω (Al) = 0,54 / 2.46 = 0.2195 (21.95%)
ω (Cu) = 78.05%
n 1 (O 2 ) = 0.015 моль
n 2 (O 2 ) = 0.015 моль
n общ . (O 2 ) = 0.03 моль
V (O 2 ) = 22,4 ∙ 0 03 = 0,672 (л)
7) При растворении в воде 15,4 г сплава калия с натрием выделилось 6,72 л водорода (н.у.) Определите молярное отношение металлов в сплаве.
Найти:
n (К) : n(Na )
m (Na 2 O )
Дано:
m (сплава) = 15,4 г
V (H 2) = 6,72 л
М (Na ) =23 г/моль
М (К) =39 г/моль
n (К) : n (Na ) = 1: 5
2К + 2H 2 O = 2 КOH + H 2
2 моль 1 моль
2Na + 2H 2 O = 2 NaOH + H 2
2 моль 1 моль
Пусть n (К) = x , n (Na ) = у, тогда
n 1 (Н 2) = 0,5 х; n 2 (Н 2) = 0,5у
n (Н 2) = 6,72 / 22,4 = 0,3 (моль)
m (К) = 39 x ; m (Na ) = 23 у
39х + 23 у = 15,4
х = 0,1, n (К) = 0,1 моль;
0,5х + 0,5у = 0,3
у = 0,5, n (Na ) = 0,5 моль
8) При обработке 9 г смеси алюминия с оксидом алюминия 40%-ным раствором гидроксида натрия (ρ =1,4 г/мл) выделилось 3,36 л газа (н.у.). Определить массовые доли веществ в исходной смеси и объём раствора щёлочи, вступивший в реакции.
Найти:
ω (Al )
ω (Al 2 O 3)
V р-ра (NaOH )
Дано:
M (см.) = 9 г
V (H 2) = 33.8мл
ω (NaOH ) = 40%
М(Al ) = 27 г/моль
М(Al 2 O 3) = 102 г/моль
М(NaOH ) = 40 г/моль
2Al + 2 NaOH + 6H 2 O = 2 Na + 3H 2
2 моль 2 моль 3 моль
Al 2 O 3 + 2 NaOH + 3H 2 O = 2 Na
1моль 2моль
n (H 2) = 3,36/22,4 = 0,15 (моль)
n (Al ) = 0,1 моль m (Al ) = 2.7 г
ω (Al) = 2,7 / 9 = 0,3 (30%)
ω (Al 2 O 3 ) = 70%
m (Al 2 O 3 ) = 9 – 2.7 = 6.3 (г)
n (Al 2 O 3 ) = 6,3 / 102 = 0,06 (моль)
n 1 (NaOH) = 0,1 моль
n 2 (NaOH) = 0,12 моль
n общ . (NaOH) = 0,22 моль
m р - ра (NaOH) = 0,22 ∙ 40 /0.4 = 22 (г)
V р - ра (NaOH) = 22 / 1.4 = 16 (мл)
Ответ: ω (Al) = 30%, ω(Al 2 O 3 ) = 70%, V р - ра (NaOH) = 16 мл
9) Сплав алюминия и меди массой 2 г обработали раствором гидроксида натрия, с массовой долей щёлочи 40 % (ρ =1,4 г/мл). Не растворившийся осадок отфильтровали, промыли и обработали раствором азотной кислоты. Полученную смесь выпарили досуха, остаток прокалили. Масса полученного продукта составила 0,8 г. Определите массовую долю металлов в сплаве и объём израсходованного раствора гидроксида натрия.
Найти:
ω (Cu ); ω (Al )
V р-ра (NaOH )
Дано:
m (смеси)=2 г
ω (NaOH )=40%
М(Al )=27 г/моль
М(Cu )=64 г/моль
М(NaOH )=40 г/моль
В щёлочи растворяется только алюминий.
2Al + 2 NaOH + 6 H 2 O = 2 Na + 3 H 2
2моль 2моль 3моль
Медь – нерастворившийся остаток.
3Cu + 8HNO 3 = 3Cu (NO 3 ) 2 + 4 H 2 O + 2 NO
3 моль 3 моль
2Cu(NO 3 ) 2 = 2 CuO + 4NO 2 + O 2
2моль 2моль
n (CuO ) = 0,8 / 80 = 0,01 (моль)
n (CuO) = n (Cu(NO 3 ) 2 ) = n (Cu) = 0,1 моль
m (Cu) = 0,64 г
ω (Cu) = 0,64 / 2 = 0,32 (32%)
ω (Al) = 68%
m (Al ) = 9 – 0,64 = 1,36(г)
n (Al ) = 1,36 / 27 = 0,05 (моль)
n (NaOH ) = 0,05 моль
m р-ра (NaOH ) = 0,05 ∙ 40 / 0.4 = 5 (г)
V р-ра (NaOH ) = 5 / 1.43 = 3,5 (мл)
Ответ: ω (Cu ) = 32%, ω (Al ) = 68%, V р-ра (NaOH ) = 3,5 мл
10) Прокалили смесь нитратов калия, меди и серебра массой 18,36 г. Объём выделившихся газов составил 4,32 л (н.у.). Твёрдый остаток обработали водой, после чего его масса уменьшилась на 3,4 г. Найти массовые доли нитратов в исходной смеси.
Найти :
ω (KNO 3 )
ω (Cu(NO 3 ) 2 )
ω (AgNO 3)
Дано:
m (смеси) = 18,36 г
∆m (твёрд. ост. )=3,4 г
V (CO 2) = 4,32 л
М (КNO 2) =85 г/моль
М (КNO 3) =101 г/моль
2 КNO 3 = 2 КNO 2 + O 2 (1)
2 моль 2 моль 1моль
2 Cu(NO 3 ) 2 = 2 CuO + 4 NO 2 + O 2 (2)
2 моль 2моль 4 моль 1 моль
2 AgNO 3 = 2 Ag + 2 NO 2 + O 2 (3)
2 моль 2моль 2моль 1моль
CuO + 2H 2 O = взаимодействие не возможно
Ag + 2H 2 O = взаимодействие не возможно
КNO 2 + 2H 2 O = растворение соли
Изменение массы твёрдого остатка произошло за счёт растворения соли, следовательно:
m (КNO 2) = 3,4 г
n (КNO 2) = 3,4 / 85 = 0,04 (моль)
n (КNO 3) = 0,04 (моль)
m (КNO 3) = 0,04∙ 101 = 4,04 (г)
ω (KNO 3) = 4,04 / 18,36 = 0,22 (22%)
n 1 (O 2) = 0,02 (моль)
n общ. (газов) = 4,32 / 22,4 = 0,19 (моль)
n 2+3 (газов) = 0,17 (моль)
m (смеси без КNO 3) = 18,36 – 4,04 = 14,32 (г)
Пусть m (Cu(NO 3 ) 2 ) = x, тогда m (AgNO 3 ) = 14,32 – x.
n (Cu(NO 3 ) 2 ) = x / 188,
n (AgNO 3) = (14,32 – x ) / 170
n 2 (газов) = 2,5х / 188,
n 3 (газов) = 1,5 ∙ (14,32 – х) / 170,
2,5х/188 + 1,5 ∙ (14,32 – х) / 170 = 0,17
х = 9,75, m (Cu(NO 3 ) 2 ) = 9,75 г
ω (Cu(NO 3 ) 2 ) = 9,75 / 18,36 = 0,531 (53,1%)
ω (AgNO 3 ) = 24,09%
Ответ: ω (KNO 3 ) = 22%, ω (Cu(NO 3 ) 2 ) = 53,1%, ω (AgNO 3 ) = 24,09%.
11) Смесь гидроксида бария, карбонатов кальция и магния массой 3,05 г прокалили до удаления летучих веществ. Масса твёрдого остатка составила 2,21 г. Летучие продукты привели к нормальным условиям и газ пропустили через раствор гидроксида калия, масса которого увеличилась на 0,66 г. Найти массовые доли веществ в исходной смеси.
ω (Вa (O Н) 2)
ω (Сa СO 3)
ω (Mg СO 3)
m (смеси) = 3,05 г
m (тв.ост.) = 2,21 г
∆ m (КОН) = 0,66 г
М (H 2 O ) =18 г/моль
М (СО 2) =44 г/моль
М (Вa (O Н) 2) =171 г/моль
М (СаСО 2) =100 г/моль
М (Mg СО 2) =84 г/моль
Вa (O Н) 2 = H 2 O + ВaO
1 моль 1моль
Сa СO 3 = СО 2 + СaO
1 моль 1моль
Mg СO 3 = СО 2 + MgO
1 моль 1моль
Масса КОН увеличилась за счёт массы поглощённого СО 2
КОН + СО 2 →…
По закону сохранения массы веществ
m (H 2 O ) =3,05 – 2,21 – 0,66 = 0,18 г
n (H 2 O ) = 0,01 моль
n (Вa (O Н) 2) = 0,01 моль
m (Вa (O Н) 2) = 1,71 г
ω (Вa (O Н) 2) = 1,71 /3.05 = 0.56 (56%)
m (карбонатов) = 3,05 – 1,71 = 1,34 г
Пусть m (Сa СO 3) = x , тогда m (Сa СO 3) = 1,34 – x
n 1 (СO 2) = n (Сa СO 3) = x /100
n 2 (СO 2) = n (Mg СO 3) = (1,34 - x )/84
x /100 + (1,34 - x )/84 = 0,015
x = 0,05, m (Сa СO 3) = 0,05 г
ω (Сa СO 3) = 0,05/3,05 = 0,16 (16%)
ω (Mg СO 3) =28%
Ответ: ω (Вa (O Н) 2) = 56%, ω (Сa СO 3) = 16%, ω (Mg СO 3) =28%
2.5 В реакцию вступает неизвестное веществ o / образуется в ходе реакции.
1) При взаимодействии водородного соединения одновалентного металла со 100 г воды получили раствор с массовой долей вещества 2,38%. Масса раствора оказалась на 0,2 г меньше суммы масс воды и исходного водородного соединения. Определите, какое соединение было взято.
Найти:
Дано:
m (H 2 O ) = 100 г
ω (МеOH ) = 2,38%
∆ m (р-ра) = 0,2 г
М (H 2 O ) = 18 г/моль
МеН + H 2 O = МеOH + Н 2
1 моль 1моль 1моль
0,1 моль 0,1моль 0,1моль
Масса конечного раствора уменьшилась на массу газа водорода.
n (Н 2) = 0,2/2 = 0,1 (моль)
n (H 2 O ) прореаг. = 0,1 моль
m (H 2 O ) прореаг = 1,8 г
m (H 2 O в р-ре ) = 100 – 1,8 = 98,2 (г)
ω (МеOH ) = m (МеOH ) / m (р-ра г/моль
Пусть m (МеOH ) = х
0,0238 = х / (98,2 + x )
x = 2,4, m (МеO Н) = 2,4 г
n (МеO Н) = 0,1 моль
М (МеO Н) = 2,4 / 0,1 = 24 (г/моль)
М (Ме) = 7 г/моль
Ме - Li
Ответ: Li Н.
2) При растворении 260 г неизвестного металла в сильно разбавленной азотной кислоте образуются две соли: Ме(N О 3 ) 2 и X . При нагревании X с гидроксидом кальция выделяется газ, который с ортофосфорной кислотой образует 66 г гидроортофосфата аммония. Определите металл и формулу соли X .
Найти:
Дано:
m (Ме) = 260 г
m ((NH 4) 2 HPO 4) = 66 г
М ((NH 4) 2 HPO 4) =132 г/моль
Ответ: Zn , соль - NH 4 NO 3.
4Me + 10HNO 3 = 4Me(NO 3 ) 2 + NH 4 NO 3 + 3H 2 O
4 моль 1 моль
2NH 4 NO 3 +Ca(OH) 2 = Ca(NO 3 ) 2 +2NH 3 + 2H 2 O
2 моль 2 моль
2NH 3 + H 3 PO 4 = (NH 4 ) 2 HPO 4
2 моль 1моль
n ((NH 4) 2 HPO 4) = 66/132 = 0.5 (моль)
n (N Н 3) = n (NH 4 NO 3) = 1 моль
n (Ме) = 4моль
М (Ме) = 260/4 = 65 г/моль
Ме - Zn
3) В 198,2 мл раствора сульфата алюминия (ρ = 1 г/мл) опустили пластину неизвестного двухвалентного металла. Через некоторое время масса пластины уменьшилась на 1,8 г, а концентрация образовавшейся соли составила 18%. Определите металл.
Найти:
ω 2 (NaOH )
Дано:
V р-ра = 198.2 мл
ρ (р-ра) = 1 г/мл
ω 1 (соли) = 18%
∆m (р-ра) =1,8 г
М (Al ) =27 г/моль
Al 2 (SO 4 ) 3 + 3Me = 2 Al+ 3MeSO 4
3 моль 2 моль 3 моль
m (р-ра до р-ции) = 198.2 (г)
m (р-ра после р-ции) = 198.2 + 1,8 = 200(г)
m (MeSO 4) в-ва = 200 ∙ 0,18 = 36 (г)
Пусть М (Ме) = х, тогда М (MeSO 4) = х + 96
n (MeSO 4) = 36 / (х + 96)
n (Ме) = 36/ (х + 96)
m (Ме) = 36x / (х + 96)
n (Al ) = 24 / (х + 96),
m (Al ) = 24 ∙ 27 / (х + 96)
m (Ме) ─ m (Al ) = ∆m (р-ра)
36x / (х + 96) ─ 24 ∙ 27 / (х + 96) = 1,8
х = 24, М (Ме) = 24 г/моль
Металл - Mg
Ответ: Mg .
4) При термическом разложении 6,4 г соли в сосуде ёмкостью 1 л при 300,3 0 С создалось давление 1430 кПа. Определите формулу соли, если при разложении её образуется вода и плохо растворимый в ней газ.
Найти:
Формулу соли
Дано:
m (соли) = 6,4 г
V (сосуда) = 1 л
Р = 1430 кПа
t =300.3 0 C
R = 8.31Дж/моль∙ К
n (газа) = PV /RT = 1430∙1 / 8,31∙ 573,3 = 0,3 (моль)
Условию задачи отвечают два уравнения:
NH 4 NO 2 = N 2 + 2 H 2 O ( газ)
1 моль 3 моль
NH 4 NO 3 = N 2 O + 2 H 2 O (газ)
1 моль 3 моль
n (соли) = 0,1 моль
М (соли) = 6,4/0,1 = 64 г/моль (NH 4 NO 2)
Ответ: NH 4 N
Литература.
1 .Н.Е.Кузьменко, В.В.Ерёмин, А.В.Попков «Химия для школьников старших классов и поступающих в ВУЗы», Москва, «Дрофа» 1999
2. Г.П.Хомченко, И.Г.Хомченко «Сборник задач по химии», Москва «Новая Волна * Оникс» 2000
3. К.Н.Зеленин, В.П.Сергутина, О.В., О.В.Солод «Пособие по химии для поступающих в Военно – медицинскую академию и другие высшие медицинские учебные заведения»,
Санкт – Петербург, 1999
4. Пособие для поступающих в медицинские институты «Задачи по химии с решениями»,
Санкт – Петербургский медицинский институт им.И.П.Павлова
5. ФИПИ «ЕГЭ ХИМИЯ» 2009 – 2015 г.
Решение расчетных задач – важнейшая составная часть школьного предмета «химия», так как это один из приёмов обучения, посредством которого обеспечивается более глубокое и полное усвоение учебного материала по химии и вырабатывается умение самостоятельного применения полученных знаний.
Чтобы научиться химии, систематическое изучение известных истин химической науки должно сочетаться с самостоятельным поиском решения сначала малых, а затем и больших проблем. Как бы ни были интересны теоретические разделы учебника и качественные опыты практикума, они недостаточны без численного подтверждения выводов теории и результатов эксперимента: ведь химия – количественная наука. Включение задач в учебный процесс позволяет реализовать следующие дидактические принципы обучения: 1) обеспечение самостоятельности и активности учащихся; 2) достижение прочности знаний и умений; 3) осуществление связи обучения с жизнью; 4) реализация предпрофильного и профильного политехнического обучения.
Решение задач является одним из звеньев в прочном усвоении учебного материала, так как формирование теорий и законов, запоминание правил и формул, составление уравнений реакций происходит в действии.
В решении химических задач целесообразно использовать алгебраические приёмы. В этом случае исследование и анализ ряда задач сводятся к преобразованиям формул и подставлению известных величин в конечную формулу или алгебраическое уравнение. Задачи по химии похожи на задачи по математике, и некоторые количественные задачи по химии (особенно на «смеси») удобнее решать через систему уравнений с двумя неизвестными.
Рассмотрим несколько таких задач.
Смесь карбонатов калия и натрия массой 7 г обработали серной кислотой, взятой в избытке. При этом выделившийся газ занял объем 1,344 л (н.у.). Определить массовые доли карбонатов в исходной смеси.
Решение.
Составляем уравнений реакций:
Обозначим через хг массу карбоната натрия в смеси, а массу карбоната калия – через (7-х)г . Объём газа, выделившегося при взаимодействии карбоната натрия с кислотой, обозначаем через у л , а объём газа, выделившегося при взаимодействии карбоната калия с кислотой, обозначаем через (1,344-у)л.
Над уравнениями реакций записываем введенные обозначения, под уравнениями реакций записываем данные, полученные по уравнениям реакций, и составляем систему уравнений с двумя неизвестными:
х/106 = у/22,4 (1)
(7-х)/138=(1,344-у) (2)
Из первого уравнения выражаем у через х :
у = 22,4х/106 (3)
(1,344-22,4х/106) 138=22,4 (7-х). (4)
Решаем уравнение (4) относительно х.
185,472-29,16х=156,8-22,4х
Следовательно, масса карбоната натрия равна 4,24 г.
Массу карбоната калия находим вычитанием из общей массы смеси карбонатов массы карбоната натрия:
7г-4,24г=2,76г.
Массовые доли карбонатов находим по формуле:
w=(m ком-та /m общая) 100%
w(Na 2 CO 3)=(4.24/7) 100%=60.57%
w(K 2 CO 3)=(2.76/7) 100%=39.43%.
Ответ: массовая доля карбоната натрия равна 60,57%, массовая доля карбоната калия равна 39,43%.
Смесь карбонатов калия и натрия массой 10 г растворили в воде и добавили избыток соляной кислоты. Выделившийся газ пропустили через трубку с пероксидом натрия. Образовавшегося кислорода хватило, чтобы сжечь 1,9 л водорода (н.у.). Напишите уравнения реакций и рассчитайте состав смеси.
Составляем уравнения реакций:
Обозначим через х г массу карбоната натрия, а масса карбоната калия будет равна (10-х)г .
По уравнению (4) рассчитаем объем кислорода, образовавшегося в процессе реакции (3).
Для этого через х в уравнении обозначим объём кислорода и, исходя из объёма водорода, составим пропорцию и решим её относительно х:
1,9/44,8=х/22,4;
х=1,9 22,4/44,8;
х=0,95л (объём выделившегося кислорода).
Исходя из уравнения (3), рассчитаем объём углекислого газа, образовавшегося при обработке смеси карбонатов натрия и калия избытком соляной кислоты. Для этого составим пропорцию:
х/44,8=0,95/22,4;
х=0,95 44,8/22,4;
Через у л обозначим объём газа, выделившегося в процессе реакции (1), а через (1,9-у)л – объём газа, выделившегося в процессе реакции (2). Составим систему уравнений с двумя неизвестными:
х/106=у/22,4 (5)
(10-х)/138=(1,9-у)/22,4 (6)
Из уравнения (5) выражаем у через х и подставляем в уравнение (6):
(10-х)/138=(1,9-22,4х/106)/22,44 (7).
Уравнение (7) решаем относительно х :
(1,9-22,4х/106) 138=22,4 (10-х);
262,2-29,16х=224-22,4х;
х=5,65г (масса карбоната натрия).
Масса карбоната калия находится как разность между массой смеси карбонатов натрия и калия и массой карбоната натрия:
10-5,65=4,35г (масса карбоната калия).
w(Na 2 CO 3)=(5,65/10) 100%
w(Na 2 CO 3)=56.5%
w(K 2 CO 3)=(4.35/10) 100%
w(K 2 CO 3)=43.5%/
Ответ: массовая доля карбоната натрия равна 56,5%, массовая доля карбоната калия равна 43,5%.
Задачи для самостоятельного решения.
Смесь железа и цинка массой 12,1 г обработали избытком раствора серной кислоты. Для сжигания полученного водорода необходимо 2,24л кислорода (давление 135,6 кПа, температура – 364К). Найдите массовую долю железа в смеси.
Смесь метиловых эфиров уксусной кислоты и пропионовой кислоты массой 47,2г обработали 83,4мл раствора гидроксида натрия с массовой долей 40% (плотность 1,2г/мл). Определите массовые доли эфиров (в %) в смеси, если известно, что гидроксид натрия, оставшийся после гидролиза эфиров, может поглотить максимально 8,96л оксида углерода (IV).
Эти задачи можно решать и другими способами, но этот способ решения задач по химии способствует развитию логического мышления, даёт возможность показать взаимосвязь математики и химии, формирует умение составлять и применять алгоритмы последовательности действий при решении, дисциплинирует и направляет деятельность на правильное использование физических величин и корректное проведение математических расчётов.
Наверное, каждый школьник или студент технического ВУЗа хотя бы раз задавался вопросом о том, как решить задачи по химии. Как показывает практика, большинство учеников считают эту науку сложной и непостижимой, часто они попросту не верят в свои силы и сдаются, так и не раскрыв свой потенциал.
На самом же деле химия является проблемой только с психологической точки зрения. Преодолев себя, осознав свои возможности, вы с легкостью освоите азы этого предмета и перейдете к более сложным вопросам. Итак, учимся решать задачи по химии быстро, правильно и легко, а также получаем максимальное удовольствие от результата.
Почему не стоит бояться вникать в науку
Химия - это не совокупность непонятных формул, обозначений и веществ. Это наука, тесно связанная с окружающей средой. Сами того не осознавая, мы сталкиваемся с ней на каждом шагу. При приготовлении пищи, влажной уборке дома, стирке, прогулке на свежем воздухе мы постоянно используем химические знания.
Следуя этой логике, когда вы поймете, как научиться решать задачи по химии, вы сможете значительно облегчить себе жизнь. А вот люди, которые сталкиваются с наукой во время учебы или работы на производстве, вообще не могут обойтись без специальных знаний и умений. Работникам медицинской сферы химия нужна не меньше, поскольку любой человек этой профессии обязан знать, как то или иное лекарство влияет на организм пациента.
Химия - это наука, которая присутствует в нашей жизни постоянно, она взаимосвязана с человеком, она является его частью. Поэтому любой ученик, осознает он это или нет, способен освоить эту отрасль знаний.
Основы химии
Прежде чем размышлять над вопросом о том, как научиться решать задачи по химии, важно понять, что без базовых знаний вам не обойтись. Азы любой науки - это фундамент ее постижения. Даже опытные специалисты при решении сложнейших задач используют эту основу, возможно, сами того не осознавая.
Итак, ознакомьтесь со списком информации, который вам понадобится:
- Валентность элементов - это фактор, с участием которого решаются любые задачи. Формулы веществ, уравнения не будут составлены правильно без этих знаний. Узнать, что такое валентность, можно в любом учебнике химии, поскольку это основное понятие, которое любой ученик должен освоить еще на первом уроке.
- Таблица Менделеева знакома практически каждому человеку. Научитесь ею правильно пользоваться, и вы сможете не удерживать у себя в голове множество сведений.
- Научитесь определять, с каким веществом вы имеете дело. Жидкое, твердое и газообразное состояние предмета, с которым вам предстоит работать, может о многом рассказать.
После получения вышеперечисленных знаний вопросов о том, как решить задачи по химии, у многих людей станет гораздо меньше. Но если вы все же так и не смогли поверить в себя, читайте далее.

Пошаговая инструкция решения любой задачи
После прочтения предыдущей информации у многих может возникнуть мнение, что крайне просто решать задачи по химии. Формулы, которые необходимо знать, возможно, действительно просты, но для освоения науки вам понадобится собрать все свое терпение, трудолюбие и настойчивость. С первого раза немногим людям удается достичь своей цели.
Со временем, при проявлении настойчивости, вы сможете решить абсолютно любую задачу. Обычно процесс состоит из таких этапов:
- Оформление краткого условия задачи.
- Составление уравнения реакции.
- Расставление коэффициентов в уравнении.
- Решение уравнения.
Опытные педагоги по химии уверяют, что для свободного решения любого типа задач нужно самостоятельно упражняться на 15 аналогичных заданиях. После этого вы свободно овладеете заданной тематикой.

Немного о теории
Нельзя размышлять о том, как решить задачи по химии, не освоив в нужной степени теоретический материал. Каким бы сухим, бесполезным и неинтересным он ни казался, это основа ваших умений. Теория применяется всегда и во всех науках. Без ее существования практика не имеет смысла. Изучайте школьную программу по химии последовательно, шаг за шагом, не пропуская даже, как вам кажется, незначительных сведений, чтобы в конечном итоге заметить прорыв в ваших знаниях.
Как решить задачи по химии: время на обучение
Часто ученики, которые освоили определенный тип задач, двигаются дальше, забывая о том, что закрепление и повторение знаний - это процесс, не менее важный, чем их получение. Каждая тема должна быть закреплена, если вы рассчитываете на долгосрочный результат. В противном случае вы очень быстро забудете всю информацию. Поэтому не ленитесь, уделите больше времени каждому вопросу.

Наконец, не забывайте о мотивации - двигателе прогресса. Хотите стать отличным химиком и удивлять окружающих огромным багажом знаний? Действуйте, старайтесь, решайте, и у вас все получится. Тогда уже с вами будут советоваться по всем химическим вопросам.
За 2-3 месяца невозможно выучить (повторить, подтянуть) такую сложную дисциплину, как химия.
Изменений в КИМ ЕГЭ 2020 г. по химии нет.
Не откладывайте подготовку на потом.
- Приступив к разбору заданий сначала изучите теорию . Теория на сайте представлена для каждого задания в виде рекомендаций, что необходимо знать при выполнении задания. направит в изучении основных тем и определяет какие знания и умения потребуются при выполнении заданий ЕГЭ по химии. Для успешной сдачи ЕГЭ по химии – теория важнее всего.
- Теорию нужно подкреплять практикой , постоянно решая задания. Так как большинство ошибок из-за того, что неправильно прочитал упражнение, не понял, что требуют в задаче. Чем чаще ты будешь решать тематические тесты, тем быстрее поймёшь структуру экзамена. Тренировочные задания разработанные на основе демоверсии от ФИПИ дают такую возможность решать и узнавать ответы. Но не спешите подглядывать. Сначала решите самостоятельно и посмотрите, сколько баллов набрали.
Баллы за каждое задание по химии
- 1 балл - за 1-6, 11-15, 19-21, 26-28 задания.
- 2 балла - 7-10, 16-18, 22-25, 30, 31.
- З балла - 35.
- 4 балла - 32, 34.
- 5 баллов - 33.
Всего: 60 баллов.
Структура экзаменационной работы состоит из двух блоков:
- Вопросы, предполагающие краткий ответ (в виде цифры или слова) – задания 1-29.
- Задачи с развернутыми ответами – задания 30-35.
На выполнение экзаменационной работы по химии отводится 3,5 часа (210 минут).
На экзамене будет три шпаргалки. И в них нужно разбираться
Это 70% информации, которая поможет успешно сдать экзамен по химии. Остальные 30% - умение пользоваться представленными шпаргалками.
- Если хочешь получить больше 90 баллов, нужно тратить на химию очень много времени.
- Чтобы сдать успешно ЕГЭ по химии, нужно много решать: , тренировочных заданий, даже если они покажутся легкими и однотипными.
- Правильно распределять свои силы и не забывать об отдыхе.
Дерзайте, старайтесь и всё у вас получится!